
Que signifie “LMC” ?
L’acronyme LMC signifie leucémie myéloïde chronique.
- Une ”leucémie” est un cancer du sang et de la moelle osseuse, une maladie qui se caractérise par la présence en surnombre de globules blancs dans le sang et/ou la moelle osseuse.1,2 On parle aussi d’hémopathie maligne.1
- ”Myéloïde” qualifie un type de cellules souches provenant de la moelle osseuse (Figure 1).3 Dans le corps, il existe deux lignées de cellules souches capables de donner naissance aux différentes cellules qui composent le sang, les globules rouges, les globules blancs et les plaquettes. Les cellules souches myéloïdes produisent les globules rouges, les plaquettes et certains globules blancs (polynucléaires et monocytes) tandis que les cellules souches lymphoïdes engendrent les lymphocytes, un autre type de globules blancs. Dans la LMC, les globules blancs anormaux, ou cellules leucémiques, sont issus des cellules souches myéloïdes.2
- “Chronique” indique que la maladie évolue lentement.3
La LMC est qualifiée de maladie rare car on estime qu’environ 10 000 à 12 000 personnes en sont atteintes en France.1,4 En 2018, 872 nouveaux cas de LMC ont été recensés en France.5
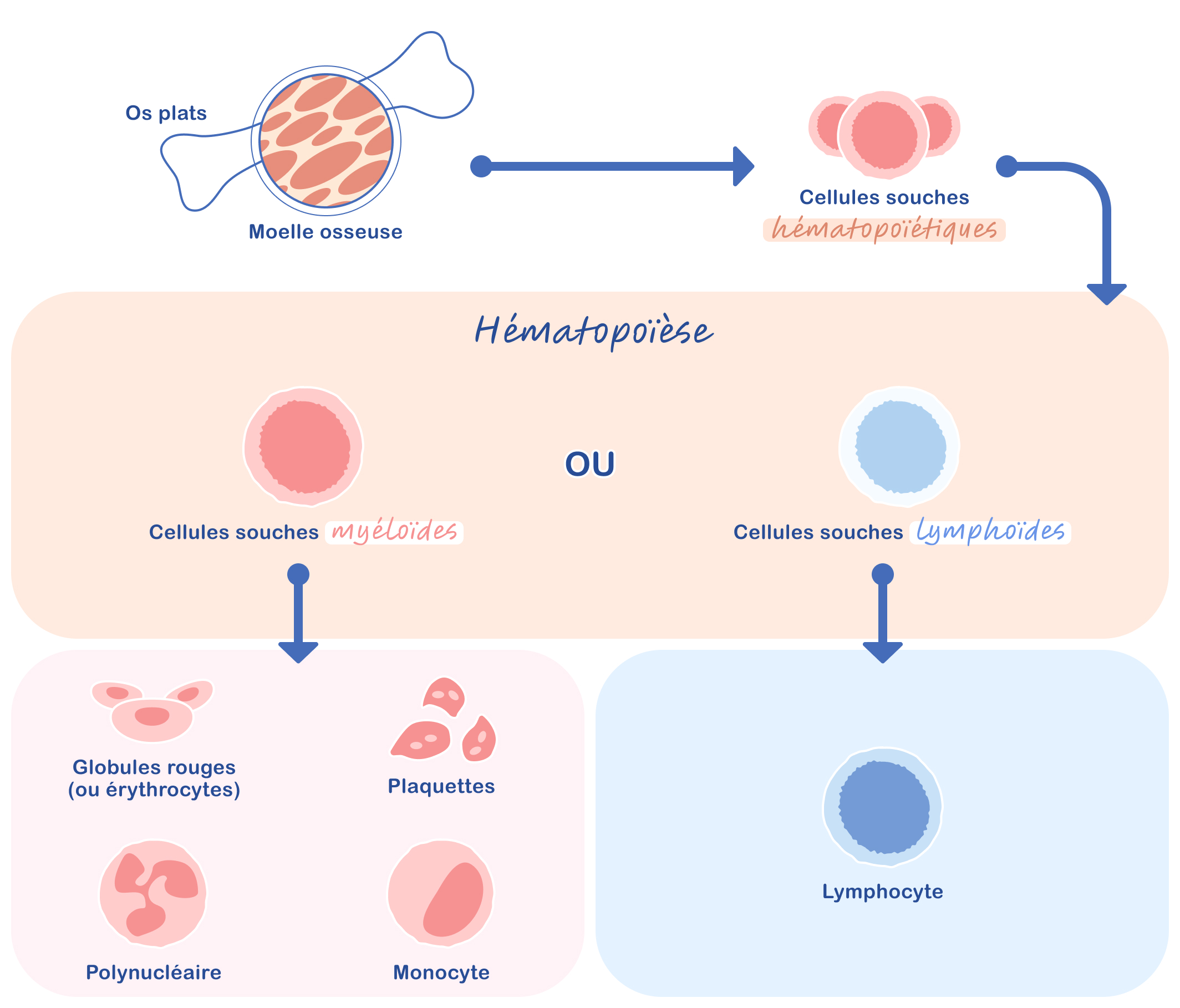
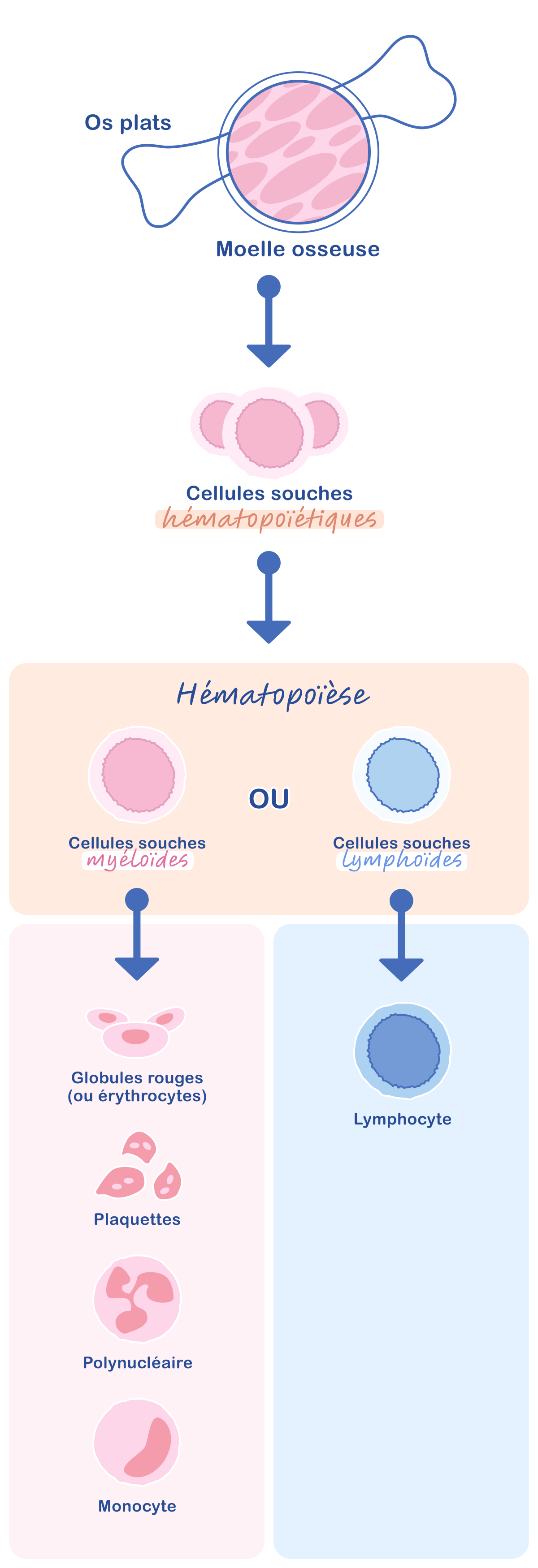
Les cellules qui constituent le sang (globules rouges, globules blancs et plaquettes) proviennent de cellules souches présentes dans la moelle osseuse, une substance située à l’intérieur des os plats (crâne, sternum, côtes, colonne vertébrale et bassin). Deux types de cellules souches génèrent les différentes cellules sanguines, les cellules souches myéloïdes et les cellules souches lymphoïdes.2
Quelles sont Les causes de la LMC ?
La LMC résulte d’une anomalie chromosomique qui survient dans une cellule souche myéloïde au cours de l’existence. Cette anomalie génétique n’est pas héritée des parents et ne se transmet pas, son origine demeure inconnue.1,2
Dans une cellule myéloïde, accidentellement, les chromosomes 9 et 22 échangent du matériel génétique conduisant à la formation du chromosome Philadelphie (le chromosome 22 modifié) et à la fusion du gène BCR provenant du chromosome 22 avec le gène ABL présent sur le chromosome 9 (Figure 2).1-3 Le nouveau gène constitué, appelé gène de fusion BCR-ABL, produit une protéine tyrosine kinase dysfonctionnelle qui est à l’origine de la LMC car elle entraîne un comportement anormal des cellules myéloïdes. Les cellules de la moelle osseuse qui expriment la protéine BCR-ABL, les cellules leucémiques, génèrent des globules blancs en excès dont une partie est immature.2,3
L’âge est un facteur de risque de la LMC, ce qui signifie que le risque de développer la maladie augmente avec les années.2,3

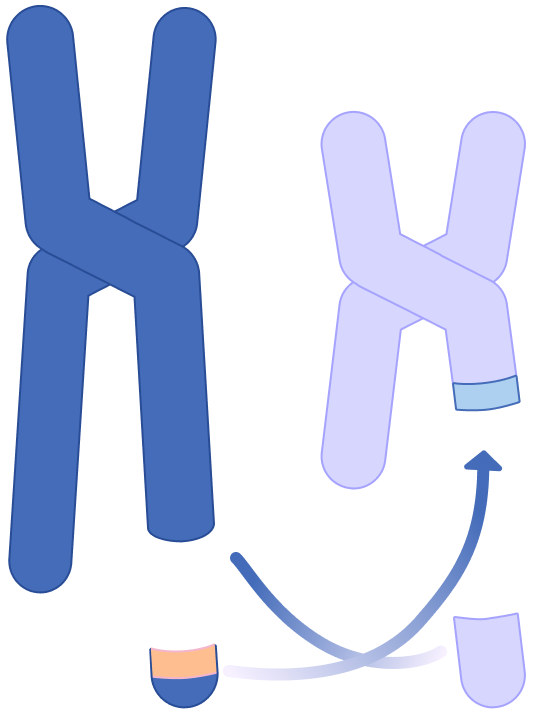

La LMC résulte d’un échange de matériel génétique entre les chromosomes 9 et 22 qui aboutit à la formation d’un chromosome 22 raccourci, le chromosome Philadelphie, porteur du gène de fusion BCR-ABL.1-3
Comment évolue la LMC ?
L’évolution naturelle de la LMC, c’est-à-dire sans qu’elle ne soit traitée, comprend 3 phases successives2,3 :

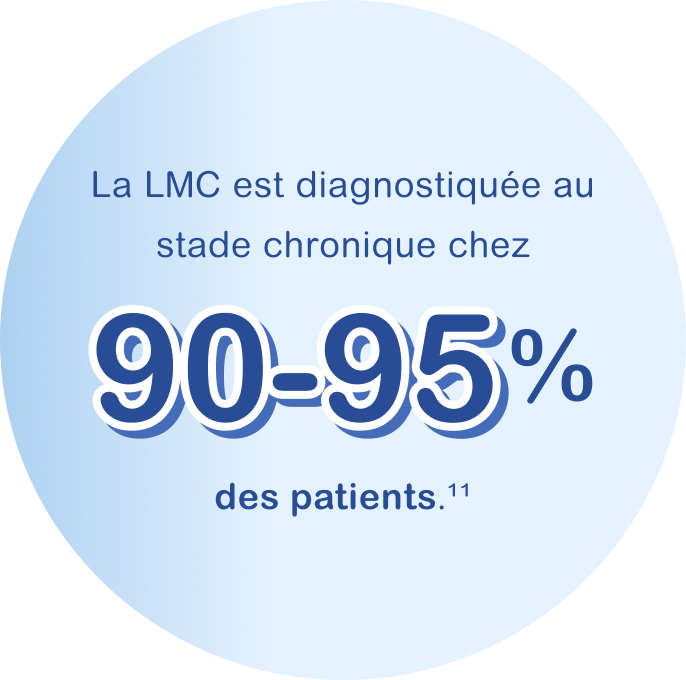
La phase chronique lors de laquelle une faible proportion (moins de 15 %) des cellules du sang ou de la moelle osseuse est anormale. La plupart des patients sont diagnostiqués durant cette phase. Pour éviter l’évolution de la LMC vers les phases suivantes, un traitement est proposé dès la phase chronique.

La phase accélérée lors de laquelle le pourcentage de cellules anormales dans le sang ou la moelle osseuse augmente jusqu’à 15-29 %. D’autres anomalies des cellules sanguines peuvent être détectées (augmentation du taux de polynucléaires basophiles > 20 %, diminution ou augmentation du taux de plaquettes).

La phase blastique ou ‘crise blastique’ correspond au stade le plus avancé de la maladie. Au moins 30 % de cellules anormales sont détectées dans le sang ou la moelle osseuse.
Sans traitement, une LMC diagnostiquée en phase chronique évolue vers la phase accélérée en 3 à 5 ans et l’espérance de vie d’un patient dont la LMC est découverte en phase accélérée ou blastique est de l’ordre de quelques mois.3
Comment est diagnostiquée la LMC ?
La LMC peut être diagnostiquée à l’aide de différents examens du sang et/ou de la moelle osseuse.
- L’hémogramme (aussi appelé numération de la formule sanguine ou NFS) permet de mesurer la quantité des différentes cellules sanguines après qu’un échantillon de votre sang ait été prélevé. Si le nombre de globules blancs est augmenté et que des cellules immatures de la moelle osseuse sont retrouvées dans le sang, une LMC est suspectée.2,3
La LMC est fréquemment découverte de manière fortuite lors d’une analyse de sang prescrite pour d’autres raisons.1 - Le myélogramme consiste à observer au microscope un échantillon de votre moelle osseuse obtenu par aspiration et/ou biopsie sous anesthésie locale, à l’aide d’une aiguille spéciale.3,6 La présence d’un grand nombre de globules blancs immatures confirme le diagnostic de LMC.2
- Le caryotype est réalisé sur un prélèvement de sang ou de moelle osseuse et consiste en l’étude des chromosomes à l’intérieur des cellules.
L’identification du chromosome Philadelphie dans les globules blancs confirme le diagnostic de LMC.2

- La réaction en chaîne par polymérase (PCR) est un test de biologie moléculaire qui permet de repérer une très petite quantité de globules blancs anormaux dans le sang ou dans la moelle osseuse en détectant l’expression du gène BCR-ABL.6,7
- La technique d’hybridation in situ en fluorescence (FISH) est un test de biologie moléculaire permettant d’identifier la présence du gène BCR-ABL dans les cellules. Il est réalisé uniquement dans le cas où le chromosome Philadelphie n’a pu être identifié sur un caryotype.3,6,7
Quels sont les symptômes de la LMC ?
D’évolution lente, la LMC n’entraîne pas forcément de symptômes les premiers mois et années de la maladie.2 Lorsqu’ils se manifestent, les symptômes de la LMC les plus fréquents sont3,6,8 :

La fatigue

Un essoufflement

Une augmentation du volume de la rate aussi appelée splénomégalie, ressentie comme une gêne ou une douleur dans la partie supérieure gauche de l’abdomen ou au niveau intestinal

Une perte de poids

Une pâleur
Ces symptômes résultent des conséquences de l’excès de globules blancs immatures dans la moelle osseuse ; les cellules leucémiques remplacent les cellules normales, induisant notamment une diminution de la production des globules rouges.3 La réduction du nombre de globules rouges ou anémie est à l’origine de la fatigue, de l’essoufflement et de la pâleur.3,6 L’accumulation de globules blancs dans la rate entraîne le gonflement de cet organe.6
Quels sont les interlocuteurs du parcours de soin des patients atteints de LMC ?

C’est le spécialiste de votre maladie et de son traitement.9 Dès la suspicion de LMC par votre généraliste, vous êtes adressé.e à ce médecin spécialiste des maladies du sang, qui vous prescrira tous les examens nécessaires pour affiner le diagnostic.9 Une fois les caractéristiques de votre maladie déterminées, votre hématologue vous prescrira un traitement adapté à votre situation.3,9 C’est lui qui assure les consultations de suivi lors desquelles vous faites le point sur votre état de santé, l’évolution de votre maladie, votre réponse au traitement et ses effets secondaires.3

La LMC étant une maladie rare, le médecin généraliste n’est pas souvent confronté à des patients qui en sont atteints. De ce fait, il collabore étroitement avec votre hématologue pour optimiser votre prise en charge et a pour rôle de faire le lien entre vous et votre hématologue.1 Votre médecin généraliste peut être capable de détecter des effets indésirables de votre traitement ou la progression de votre maladie lors de vos visites pour d’autres raisons médicales.10

Dans certains services hospitaliers, l’infirmière coordinatrice assure la continuité du lien avec votre hématologue en facilitant la communication et l’échange d’informations sur votre maladie et son traitement.1
Chiffres clés



La prise en charge de la LMC
Vous trouverez dans ce second onglet diverses informations concernant la prise en charge de la LMC.
Librairie pédagogique
Vous trouverez dans cet onglet divers éléments utiles et pertinents concernant la LMC.
- LMC France. Livre blanc des 2nds Etats généraux de la leucémie myéloïde chronique. 2016
- Fondation ARC. Les leucémies chroniques de l’adulte. 2023
- ESMO/FAC. Leucémie myéloïde chronique : un guide pour les patients. 2013
- Orphanet. Leucémie myéloïde chronique. Consulté le 29/11/2023
- Defossez G, Le Guyader‑Peyrou S, Uhry Z, et al. Estimations nationales de l’incidence et de la mortalité par cancer en France métropolitaine entre 1990 et 2018. Synthèse. Saint‑Maurice: Santé publique France, Juillet 2019.
- Leukemia and Lymphoma Society. The CML Guide. Information for Patients and Caregivers. Chronic Myeloid Leukemia. 2014
- Hochhaus A, Baccarani M, Silver RT, et al. European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia. Leukemia. 2020;34(4):966-984.
- Orphanet. Signes cliniques et symptômes. Consulté le 29/11/2023
- LMC France. Livre blanc des 1ers Etats généraux de la leucémie myéloïde chronique. 2013
- Granatowicz A, Piatek CI, Moschiano E, El-Hemaidi I, Armitage JD, Akhtari M. An Overview and Update of Chronic Myeloid Leukemia for Primary Care Physicians. Korean J Fam Med. 2015;36(5):197-202.
- Hochhaus A, Saussele S, Rosti G, etal. Chronic myeloid leukaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017;28(suppl_4):iv41-iv51.